L’obésité représente la deuxième cause de mortalité évitable aux États-Unis. Elle est étroitement liée à de nombreuses comorbidités graves, telles que le diabète de type 2 (DT2), la stéatose hépatique métabolique (MASLD, anciennement connue sous le nom de NAFLD), les maladies cardiovasculaires et certains cancers.
Initialement conçus pour le traitement du DT2, les agonistes des récepteurs du GLP-1, du GIP et du glucagon ont récemment démontré un potentiel thérapeutique prometteur dans la prise en charge de l’obésité.
Cayman propose ces composés exclusivement à des fins de recherche, dans le but de soutenir les travaux scientifiques sur les pathologies métaboliques telles que le DT2 et l’obésité. Cet article se penche sur les bases scientifiques qui sous-tendent l’utilisation de ces agents innovants
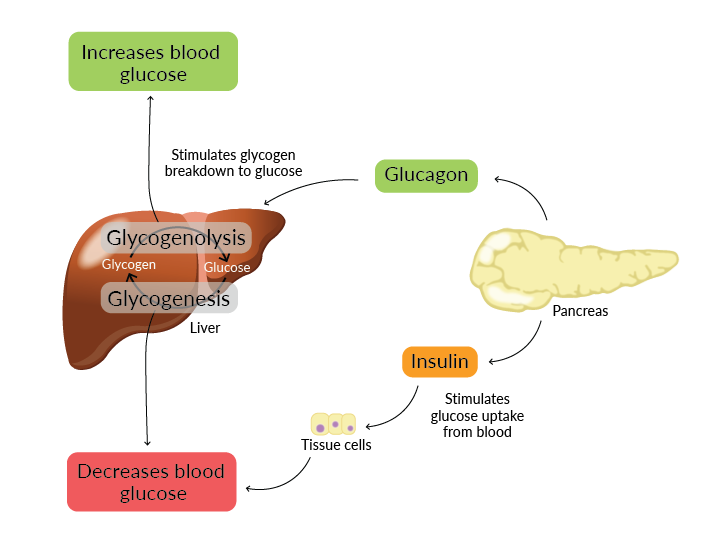
L’insuline et le glucagon régulent l’homéostasie du glucose
La régulation de la glycémie est largement contrôlée par deux hormones pancréatiques : l’insuline et le glucagon. Ces hormones ont des actions opposées mais complémentaires.
- L’insuline est sécrétée lorsque la glycémie est élevée (hyperglycémie). Elle réduit le taux de glucose sanguin en signalant aux cellules d’absorber le glucose pour le transformer en énergie ou le stocker.
- Le glucagon, quant à lui, est sécrété en cas de glycémie basse (hypoglycémie). Il stimule la production de glucose par le foie via la glycogénolyse, augmentant ainsi la glycémie.
Les incrétines GLP-1 et GIP régulent la glycémie en stimulant la sécrétion d’insuline après un repas
Le taux de glucose sanguin augmente généralement après un repas et diminue pendant le jeûne. Après la consommation d’aliments, le glucose — une source d’énergie essentielle — est libéré dans le sang, entraînant une élévation de la glycémie.
Pour stimuler la sécrétion d’insuline après le repas, l’organisme utilise deux hormones incrétines produites dans l’intestin : le GLP-1 et le GIP. Ces hormones sont libérées après l’ingestion d’aliments et stimulent la sécrétion d’insuline par le pancréas, signalant aux cellules d’absorber le glucose, ce qui réduit la glycémie postprandiale.
Le GLP-1 régule aussi l’appétit et la prise alimentaire
En plus de stimuler l’insuline, le GLP-1 (mais pas le GIP) :
- ralentit la vidange gastrique,
- diminue la motilité intestinale,
- réduit l’appétit et la prise alimentaire,
- stimule la dépense énergétique via des mécanismes centraux et périphériques complexes.
Ces effets favorisent la perte de poids, faisant des agonistes du récepteur GLP-1 (GLP-1R) une option thérapeutique précieuse dans la prise en charge de l’obésité.
Voir toutes les hormones peptidiques liées à la prise alimentaire disponibles chez Cayman
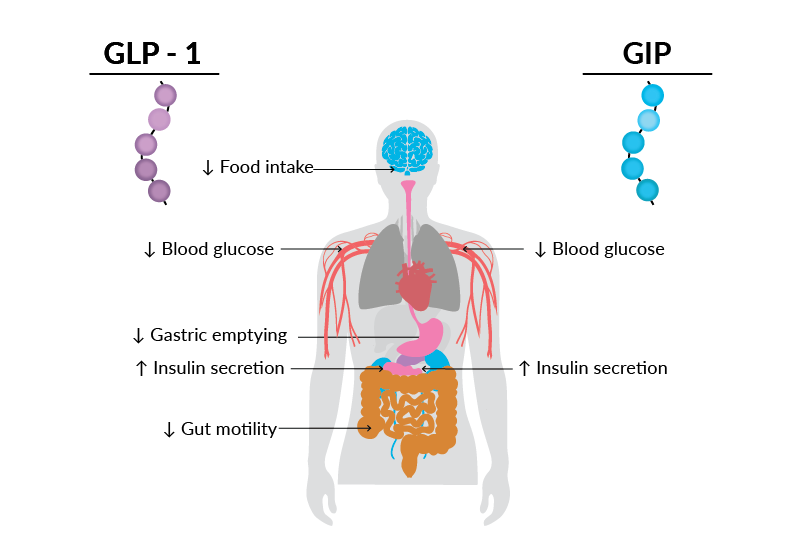
Figure 2 : Résumé des actions du GLP-1 et du GIP dans l’homéostasie du glucose et la réduction du poids
Thérapies basées sur les incrétines pour la recherche sur l’obésité
Agonistes simples
Le sémaglutide, un agoniste du GLP-1R, est un analogue peptidique utilisé pour favoriser la perte de poids. Il permet une perte de poids significative lorsqu’il est associé à des modifications du mode de vie (régime, exercice), comparé à ces changements seuls.
D’autres agonistes peptidiques du GLP-1R existent, comme la lixisénatide, la liraglutide, la dulaglutide et l’exénatide. Ils diffèrent par leur structure, taille, pharmacocinétique, efficacité et sécurité, offrant ainsi diverses options selon les profils individuels.
Les thérapies non peptidiques peuvent présenter certains avantages : contrairement aux peptides injectables, les agonistes non peptidiques (comme orforglipron) ou les modulateurs allostériques positifs (comme V-0219) peuvent être administrés par voie orale. Ces traitements sont actuellement en phase d’essais cliniques.
Voir tous les agonistes GLP-1R disponibles chez Cayman
Agonistes doubles
Le tirzépatide est un agoniste double des récepteurs GLP-1R et GIPR, une innovation de premier ordre. Même si le GIP seul n’a pas d’effet net sur l’appétit ou la vidange gastrique, l’association GLP-1 + GIP présente un effet synergique, entraînant de meilleurs résultats que le GLP-1 seul.
Ces agonistes dits « twincrétines » offrent également un meilleur profil de tolérance grâce à leurs mécanismes d’action combinés. Leur succès a stimulé l’intérêt pour des traitements ciblant plusieurs voies métaboliques.
Voir tous les agonistes doubles GLP-1R et GIPR disponibles chez Cayman
Agonistes triples
Une nouvelle stratégie thérapeutique consiste à cibler trois récepteurs hormonaux.
Les antagonistes du récepteur du glucagon (GCGR) ont d’abord été étudiés dans le traitement du DT2 car ils réduisent la production de glucose et stimulent l’insuline. Cependant, leur développement a été freiné en raison d’effets secondaires comme la stéatose hépatique, un facteur de risque du MASLD.
Paradoxalement, les agonistes du GCGR — bien qu’hyperglycémiants — favorisent la satiété et la dépense énergétique via la thermogenèse. En les combinant avec des agents qui augmentent la sécrétion d’insuline, il est possible de compenser l’élévation de la glycémie, ouvrant la voie à des thérapies polyagonistes.
Un exemple prometteur est le rétatrutide, un agoniste triple ciblant les récepteurs GLP-1R, GIPR et GCGR, qui a montré des résultats encourageants en essais cliniques.
Voir tous les agonistes triples GLP-1R, GIPR et GCGR disponibles chez Cayman
| Description | GLP-1R Agonists | GIPR Agonists | GCGR Agonists |
| Semaglutide A peptide analog |
|||
| Lixisenatide A peptide analog |
|||
| Dulaglutide A peptide analog |
|||
| Exendin A peptide analog |
|||
| Orforglipron A non-peptide agonist |
|||
| V-0219 A non-peptide positive allosteric modulator |
|||
| LSN3318839 A non-peptide positive allosteric modulator |
|||
| Taspoglutide (acetate) A peptide analog |
|||
| Liraglutide A peptide analog |
|||
| Tirzepatide A peptide analog |
|||
| Bamadutide A peptide analog |
|||
| Cotadutide (acetate) A peptide analog |
|||
| Survodutide A peptide analog |
|||
| Mazdutide A peptide analog |
|||
| Retatrutide A peptide analog |
|||
| SAR441255 (sodium salt) A peptide analog |
|||
| These products are for scientific research use only. | |||
Vers de nouvelles perspectives
Bon nombre de ces thérapies initialement développées pour le diabète de type 2 sont non seulement étudiées dans le cadre de l’obésité, mais aussi dans d’autres pathologies associées à celle-ci, notamment l’insuffisance cardiaque et les maladies cardiovasculaires.¹⁹–²² Plusieurs de ces mêmes agents présentent également un potentiel bénéfique pour le traitement d’autres troubles, tels que les troubles liés à l’usage de substances et les maladies neurodégénératives comme la maladie d’Alzheimer et la maladie de Parkinson.²³–²⁶
En savoir plus :
- Disponible chez Cayman :

- Cayman propose des produits et des ressources pour soutenir la recherche sur le diabète et/ou l’obésité.
- Voir tous les outils de recherche pour le diabète
- Voir tous les outils de recherche pour l’obésité
- Contact pour tout support technique, applicatif ou commercial :
- Téléphone : +33 4 70 03 73 06
- Email : consumables.eu@advion-interchim.com
- Suivez nos actualités sur LinkedIn
References
- Wang, Y., Beydoun, M.A., Min, J., et al. Has the prevalence of overweight, obesity and central obesity levelled off in the United States? Trends, patterns, disparities, and future projections for the obesity epidemic. Int. J. Epidemiol. 49(3), 810-823 (2020).
- Zhang, X., Ha, S., Lau, H. C.-H., et al. Excess body weight: Novel insights into its roles in obesity comorbidities. Semin. Cancer Biol. 92, 16-27 (2023).
- Röder, P.V., Wu, B., Liu, Y., et al. Pancreatic regulation of glucose homeostasis. Exp. Mol. Med. 48(3), e219 (2016).
- Nakrani, M.N., Wineland, R.H., and Anjum, F. Physiology, glucose metabolism. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing (2024). Available from: https://www.ncbi.nlm.nih.gov/books/NBK560599/
- Baggio, L.L. and Drucker, D.J. Biology of incretins: GLP-1 and GIP. Gastroenterology 132(6), 2131-2157 (2007).
- Nauck, M.A., Quast, D.R., Wefers, J. et al. The evolving story of incretins (GIP and GLP-1) in metabolic and cardiovascular disease: A pathophysiological update. Diabetes Obes. Metab. 23(Suppl 3), 5-29 (2021).
- González-García, I., Milbank, E., Diéguez, C., et al. Glucagon, GLP-1 and thermogenesis. Int. J. Mol. Sci. 20(14), 3445 (2019).
- Holst, J.J. and Rosenkilde, M.M. GIP as a therapeutic target in diabetes and obesity: Insight from incretin co-agonists. J. Clin. Endocrinol. Metab. 105(8), e2710-e2716 (2020).
- Edholm, T., Degerblad, M., Grybӓck, P. et al. Differential incretin effects of GIP and GLP-1 on gastric emptying, appetite, and insulin-glucose homeostasis. Neurogastroenterol. Motil. 22(11), 1191-1200, e315 (2010).
- Wadden, T.A., Chao, A.M., Moore, M., et al. The role of lifestyle modification with second-generation anti-obesity medications: Comparisons, questions, and clinical opportunities. Curr. Obes. Rep. 12(4), 453-473 (2023).
- Almandoz, J.P., Lingvay, I., Morales, J., et al. Switching between glucagon-like peptide-1 receptor agonists: Rationale and practical guidance. Clin. Diabetes 38(4), 390-402 (2020).
- Malik, F. and Li, Z. Non‐peptide agonists and positive allosteric modulators of glucagon‐like peptide‐1 receptors: Alternative approaches for treatment of type 2 diabetes. Br. J. Pharmacol. 179(4), 511-525 (2022).
- Wharton, S., Blevins, T., Connery, L., et al. Daily oral GLP-1 receptor agonist orforglipron for adults with obesity. N. Engl. J. Med. 389(10), 877-888 (2023).
- Decara, J.M., Vázquez-Villa, H., Brea, J., et al. Discovery of V-0219: A small-molecule positive allosteric modulator of the glucagon-like peptide-1 receptor toward oral treatment for “diabesity”‘. J. Med. Chem. 65(7), 5449-5461 (2022).
- Lin, F., Yu, B., Ling, B., et al. Weight loss efficiency and safety of tirzepatide: A systematic review. PLoS One 18(5), e0285197 (2023).
- Hope, D.C.D., Vincent, M.L., and Tan, T.M.M. Striking the balance: GLP-1/glucagon co-agonism as a treatment strategy for obesity. Front. Endocrinol.(Lausanne) 12, 735019 (2021).
- Novikoff, A. and Müller, T.D. The molecular pharmacology of glucagon agonists in diabetes and obesity. Peptides 165, 171003 (2023).
- Naeem, M., Imran, L., and Banatwala, U.E.S.S. Unleashing the power of retatrutide: A possible triumph over obesity and overweight: A correspondence. Health Sci. Rep. 7(2), e1864 (2024).
- Kosiborod, M.N, Abildstrøm, S.Z., Borlaug, B.A., et al. Semaglutide in patients with heart failure with preserved ejection fraction and obesity. N. Engl. J. Med. 389(12), 1069-1084 (2023).
- Husain, M., Bain, S.C., Jeppesen, O.K., et al. Semaglutide (SUSTAIN and PIONEER) reduces cardiovascular events in type 2 diabetes across varying cardiovascular risk. Diabetes Obes. Metab. 22(3), 442-451 (2020).
- Ryan, D.H., Lingvay, I., Colhoun, H.M., et al. Semaglutide effects on cardiovascular outcomes in people with overweight or obesity (SELECT) rationale and design. Am. Heart J. 229, 61-69 (2020).
- Edwards, K.L. and Minze, M.G. Dulaglutide: An evidence-based review of its potential in the treatment of type 2 diabetes. Core Evid. 10, 11-21 (2015).
- Thomsen, M., Holst, J.J., Molander, A., et al. Effects of glucagon-like peptide 1 analogs on alcohol intake in alcohol-preferring vervet monkeys. Psychopharmacology(Berl.) 236(2), 603-611 (2019).
- Yammine, L., Green, C.E., Kosten, T.R., et al. Exenatide adjunct to nicotine patch facilitates smoking cessation and may reduce post-cessation weight gain: A pilot randomized controlled trial. Nicotine Tob. Res. 23(10), 1682-1690 (2021).
- Leggio, L., Hendershot, C.S., Farokhnia, M., et al. GLP-1 receptor agonists are promising but unproven treatments for alcohol and substance use disorders. Nat. Med. 29(12), 2993-2995 (2023).
- Mahapatra, M.K., Karuppasamy, M., and Sahoo, B.M. Therapeutic potential of semaglutide, a newer GLP-1 receptor agonist, in abating obesity, non-alcoholic steatohepatitis and neurodegenerative diseases: A narrative review. Pharm. Res. 39(6), 1233-1248 (2022).